Příprava oxidu zinečnatého (zinkové běloby)
ZnO : bílý prášek (hexagonální mřížka) nepatrně rozpustný ve vodě. Rozpustný v kyselinách a roztocích hydroxidů alkalických kovů. Nerozpustný v NH3(aq). Teplota tání: 1950 až 2000°C. V čistém stavu se používá v lékařství jako tzv. zinková mast (10g ZnO a 90g čisté vazelíny), při výrobě barev a emailů se užívá jako zinková běloba.
Postup přípravy je možné rozdělit do tří následných kroků:
- Příprava roztoku chloridu zinečnatého:
Zn + 2 HCl ?› ZnCl2 + H2 - Příprava hydroxidu zinečnatého srážením roztoku chloridu zinečnatého roztokem hydroxidu sodného:
ZnCl2 + 2 NaOH ?› Zn(OH)2 + 2 NaCl - Příprava oxidu zinečnatého termickým rozkladem hydroxidu zinečnatého:
Zn(OH)2 ?› ZnO + H2O
Chemikálie a pomůcky:
Granulovaný zinek, roztok kyseliny chlorovodíkové (w = 0,20) /Xi (10-25)/, roztok hydroxidu sodného (w = 0,20) /C (2+)/.
Postup práce: * Granulku zinku o hmotnosti cca 1g vložte do zkumavky s postraním vývodem.
* Sestavte aparaturu pro vývoj a jímání plynu nad vodou.
* Z dělící nálevky přidejte 7ml 20% HCl a unikající vodík jímejte nad vodou do odměrného válce.
* K roztoku chloridu zinečnatého přidávejte po kapkách 20% roztok NaOH do alkalické reakce.
* Pozor ! V nadbytku hydroxidu se sraženina rozpustí - vzniká Na2[Zn(OH)]4.
* Vyloučenou bílou sraženinu odsajte a promyjte vodou.
* Zahřejte sušárnu na teplotu 130°C, při které dojte k termickému rozkladu hydroxidu zinečnatého na příslušný oxid.
* Sestavte aparaturu pro vývoj a jímání plynu nad vodou.
* Z dělící nálevky přidejte 7ml 20% HCl a unikající vodík jímejte nad vodou do odměrného válce.
* K roztoku chloridu zinečnatého přidávejte po kapkách 20% roztok NaOH do alkalické reakce.
* Pozor ! V nadbytku hydroxidu se sraženina rozpustí - vzniká Na2[Zn(OH)]4.
* Vyloučenou bílou sraženinu odsajte a promyjte vodou.
* Zahřejte sušárnu na teplotu 130°C, při které dojte k termickému rozkladu hydroxidu zinečnatého na příslušný oxid.
m(Zn) = 1 g
M(Zn) = 65,39 g/mol
m(HCl) = ?
M (HCl) = 36,46 g/mol
?(HCl, 20%) = 1,098 g.cm-3
Zn + 2 HCl ?› ZnCl2 + H2
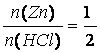
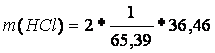
m(HCl) = 1,1 g 100%
x g …………...100% (HCl)
1,1g …………...20% (HCl)
x = 1,1*100/20 = 5,5 g
V = m/?
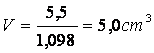
V(HCl) = 5 cm3 20%
M(Zn) = 65,39 g/mol
m(HCl) = ?
M (HCl) = 36,46 g/mol
?(HCl, 20%) = 1,098 g.cm-3
Zn + 2 HCl ?› ZnCl2 + H2
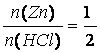
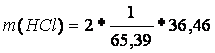
m(HCl) = 1,1 g 100%
x g …………...100% (HCl)
1,1g …………...20% (HCl)
x = 1,1*100/20 = 5,5 g
V = m/?
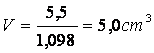
V(HCl) = 5 cm3 20%


