Příprava hexahydrátu dusičnanu nikelnatého
Ni(NO3)2• 6 H2O : zelené až modrozelené krystaly (triklinická mřížka), teplota tání: 56,7°C!. Rozpustnost: ve 100cm3 vody se při 20°C rozpustí 356g soli. Rozpustný též v NH3(aq), methanolu, ethanolu, málo rozpustný v acetonu.
Hexahydrát dusičnanu nikelnatého se připraví neutralizační reakcí hydroxidu nikelnatého s koncentrovanou kyselinou dusičnou.
Ni(OH)2 + 2 HNO3 + 6 H2O ?› Ni(NO3)2• 6 H2O + 2 H2O
Ni(OH)2 + 2 HNO3 + 6 H2O ?› Ni(NO3)2• 6 H2O + 2 H2O
Chemikálie a pomůcky:
Hydroxid nikelnatý /Xn/, kyselina dusičná (konc.) /O, C 5+/.
Postup práce: * Čerstvě připravený Ni(OH)2 /Xn/ vneste do kádinky (250 cm3).
* Přilijte 40 cm3 vody a sraženinu rozmíchejte.
* Po kapkách přidávejte konc. HNO3 až do rozpuštění sraženiny.
* Roztok zahustěte a nechte volně krystalovat.
* Přilijte 40 cm3 vody a sraženinu rozmíchejte.
* Po kapkách přidávejte konc. HNO3 až do rozpuštění sraženiny.
* Roztok zahustěte a nechte volně krystalovat.
m(Ni(SO4).7H2O) = 1 g
M(Ni(SO4).7H2O) = 280,86 g/mol
M(Ni(NO3)2. 6 H2O) = 290,79 g/mol
m(Ni(NO3)2. 6 H2O) = ?
M(Ni(OH)2) = 92,7 g/mol
NiSO4 • 7 H2O + 2 NaOH ?› Ni(OH)2 + Na2SO4 + 7 H2O
Ni(OH)2 + 2 HNO3 + 6 H2O ?› Ni(NO3)2• 6 H2O + 2 H2O
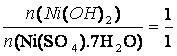
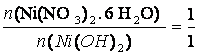
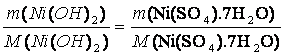
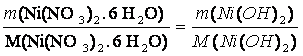
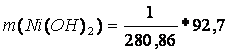
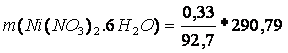
m(Ni(OH)2) = 0,33
m(Ni(NO3)2. 6 H2O) = 1,04g
M(Ni(SO4).7H2O) = 280,86 g/mol
M(Ni(NO3)2. 6 H2O) = 290,79 g/mol
m(Ni(NO3)2. 6 H2O) = ?
M(Ni(OH)2) = 92,7 g/mol
NiSO4 • 7 H2O + 2 NaOH ?› Ni(OH)2 + Na2SO4 + 7 H2O
Ni(OH)2 + 2 HNO3 + 6 H2O ?› Ni(NO3)2• 6 H2O + 2 H2O
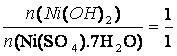
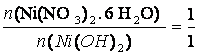
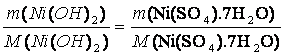
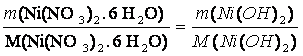
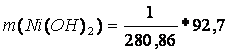
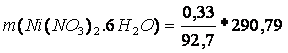
m(Ni(OH)2) = 0,33
m(Ni(NO3)2. 6 H2O) = 1,04g


