Příprava chloridu hexaaminkobaltitého
[Co(NH3)6]Cl3 : žlutohnědé až žlutooranžové, na vzduchu stálé, krystaly (monoklinická mřížka).
Teplota tání: 215°C (za uvolnění amoniaku). Rozpustnost ve vodě stoupá s rostoucí teplotou: při 0°C se
rozpustí ve 100cm3 vody 4,07g při 20°C 6,95g a při 45°C již 11,23g [Co(NH3)6]Cl3.
Hodnota konstanty stability komplexního kationu [Co(NH3)6]3+: 4,54.1023 (při 25°C).
Příprava komplexu Co2+ působením koncentrovaného amoniaku na chlorid kobaltnatý v roztoku obsahujícím amonnou sůl a jeho oxidace vzdušným kyslíkem na komplex Co3+. Při reakci působí jako katalyzátor práškové uhlí.
4 CoCl2• 6 H2O + 4 NH4Cl + 20 NH3 + O2 ?› 4 [Co(NH3)6]Cl3 + 26 H2O
Chemikálie a pomůcky:
Hexahydrát chloridu kobaltnatého, chlorid amonný /Xn/, práškové aktivní uhlí, vodný roztok amoniaku (konc.) /C (10+), N/, kyselina chlorovodíková (w = 20%) /Xi (10-25)/, kyselina chlorovodíková (konc.) /C (25+)/.
Postup práce: * V kuželové baňce protřepávejte 5 cm3 destilované vody s 6g hexahydrátu chloridu kobaltnatého a 4g chloridu amonného.
* Jakmile se soli téměř rozpustí, přidejte 0,15g aktivního uhlí a 13 cm3 konc. vodného roztoku amoniaku.
* Reakční směs nechte promíchávat magnetickým míchadlem.
* Proud vzduchu zavádějte tak dlouho, až původně červený roztok přejde v žlutohnědý a jeho barva se již nemění (cca 1,5-2hod.). Pro zavádění vzduchu lze též užít vývěvu. Ověřte správné připojení odsávací hadičky !
* Poté produkt vysrážejte přidáním 10 cm3 konc. kys. chlorovodíkové za současného chlazení vodou a ledem.
* Vyloučené krystaly odsajte na fritě.
* Jakmile se soli téměř rozpustí, přidejte 0,15g aktivního uhlí a 13 cm3 konc. vodného roztoku amoniaku.
* Reakční směs nechte promíchávat magnetickým míchadlem.
* Proud vzduchu zavádějte tak dlouho, až původně červený roztok přejde v žlutohnědý a jeho barva se již nemění (cca 1,5-2hod.). Pro zavádění vzduchu lze též užít vývěvu. Ověřte správné připojení odsávací hadičky !
* Poté produkt vysrážejte přidáním 10 cm3 konc. kys. chlorovodíkové za současného chlazení vodou a ledem.
* Vyloučené krystaly odsajte na fritě.
m(CoCl2. 6 H2O) = 6g
M(CoCl2. 6 H2O) = 237,93 g/mol
M([Co(NH3)6]Cl3) = 267,5 g/mol
m([Co(NH3)6]Cl3) = ?
4 CoCl2• 6 H2O + 4 NH4Cl + 20 NH3 + O2 ?› 4 [Co(NH3)6]Cl3 + 26 H2O
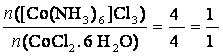
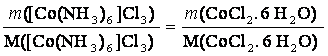
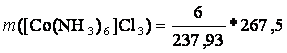
m([Co(NH3)6]Cl3) = 6,75g
M(CoCl2. 6 H2O) = 237,93 g/mol
M([Co(NH3)6]Cl3) = 267,5 g/mol
m([Co(NH3)6]Cl3) = ?
4 CoCl2• 6 H2O + 4 NH4Cl + 20 NH3 + O2 ?› 4 [Co(NH3)6]Cl3 + 26 H2O
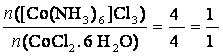
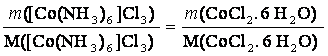
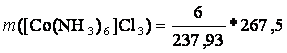
m([Co(NH3)6]Cl3) = 6,75g


