Příprava hexahydrátu síranu amonno-železnatého (Mohrovy soli)
(NH4)2Fe(SO4)2• 6 H2O : tvoří světle zelené – zelenomodré krystaly (monoklinická mřížka), v nichž je Fe2+ mnohem stálejší vůči oxidaci vzdušným kyslíkem než Fe2+ v síranu železnatém. Právě pro svou relativní stálost se Mohrova sůl užívá jako standard v manganometrii. Zahřátím nad 100°C ztrácí krystalovou vodu, při 170°C odštěpuje amoniak. Za normální teploty lze sůl přechovávat beze změn. Rozpustnost: při 10°C 25,4g soli ve 100g destilované vody, při 50°C 65,1g soli ve 100g destilované vody.
Reakce síranu amonného s heptahydrátem síranu železnatého.
(NH4)2SO4 + FeSO4• 7 H2O ?› (NH4)2Fe(SO4)2• 6 H2O + H2O
(NH4)2SO4 + FeSO4• 7 H2O ?› (NH4)2Fe(SO4)2• 6 H2O + H2O
Chemikálie a pomůcky:
Síran amonný, heptahydrát síranu železnatého, kys. sírová (konc.) /C (15+)/.
Postup práce: * K 11 cm3 destilované vody přidejte 1 cm3 konc. kys. sírové, zahřejte na 80?C a rozpusťte v ní 2,5g (NH4)2SO4.
* Přidejte 5,3 g FeSO4• 7 H2O a rozpusťte.
* Směs v kádince chlaďte pod proudem ledové vody do úplného ochlazení směsi a vyloučení krystalků. Proces krystalizace lze urychlit třením tyčinky o stěnu.
* Vyloučené krystalky odsajte na fritě.
* Přidejte 5,3 g FeSO4• 7 H2O a rozpusťte.
* Směs v kádince chlaďte pod proudem ledové vody do úplného ochlazení směsi a vyloučení krystalků. Proces krystalizace lze urychlit třením tyčinky o stěnu.
* Vyloučené krystalky odsajte na fritě.
m((NH4)2SO4) = 2,5 g
M((NH4)2SO4) = 132,14 g/mol
M(FeSO4.7H2O) = 278,01 g/mol
m(FeSO4.7H2O) = ?
(NH4)2SO4 + FeSO4• 7 H2O ?› (NH4)2Fe(SO4)2• 6 H2O + H2O
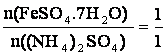
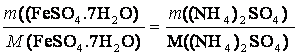
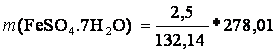
m(FeSO4.7H2O) = 5,26g
M((NH4)2SO4) = 132,14 g/mol
M(FeSO4.7H2O) = 278,01 g/mol
m(FeSO4.7H2O) = ?
(NH4)2SO4 + FeSO4• 7 H2O ?› (NH4)2Fe(SO4)2• 6 H2O + H2O
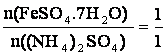
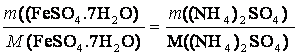
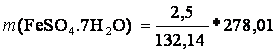
m(FeSO4.7H2O) = 5,26g


