Příprava oxidu chromitého
Cr2O3: zelený prášek (romboedrická mřížka), nerozpustný ve vodě. Je nejstálejší ze všech oxidů chromu. Snadno se dá připravit tepelným rozkladem dichromanu amonného. Takto „suchou cestou“ připravený Cr2O3 je obvykle málo reaktivní a dá se jen obtížně převést do roztoku rozpouštěním v kyselinách. Naproti tomu hydratovaný oxid („hydroxid“), který se vylučuje z vodných roztoků chromitých solí srážením, je amfoterní a snadno se rozpouští v kyselinách za vzniku příslušných solí chromitých, obsahujících kation [Cr(H2O)6]3+. Rozpouští se i v roztocích alkalických hydroxidů za vzniku rozsáhle hydrolyzovaných chromitanů. Tavením na vzduchu s hydroxidy a dusičnany alkalických kovů přechází na alkalické chromany. Teplota tání: 2437?C.
Oxid chromitý se připraví redukcí dichromanu draselného sírou.
K2Cr2O7 + S ?› Cr2O3 + K2SO4
K2Cr2O7 + S ?› Cr2O3 + K2SO4
Chemikálie a pomůcky:
Dichroman draselný /T+ (7+), N/, prášková síra.
Postup práce: * Jemně rozetřete 4g K2Cr2O7 s 1g síry a směs vysypte do porcelánového kelímku.
* Opatrně zahřívejte, zahřívání ukončete v okamžiku vzplanutí směsi.
* Pozor ! Pokus provádějte v digestoři, protože současně vzniká i oxid siřičitý.
* Po vychladnutí ponořte kelímek do kádinky s vodou, obsah vyloužete, odsajte a promyjte vodou.
* Opatrně zahřívejte, zahřívání ukončete v okamžiku vzplanutí směsi.
* Pozor ! Pokus provádějte v digestoři, protože současně vzniká i oxid siřičitý.
* Po vychladnutí ponořte kelímek do kádinky s vodou, obsah vyloužete, odsajte a promyjte vodou.
m(Cr2O3) = 2 g
M(Cr2O3) = 151,99 g/ mol
M(S) = 32,06 g/ mol
m(S) = ?
K2Cr2O7 + S ?› Cr2O3 + K2SO4
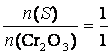
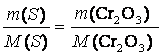
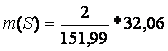
m(S) = 0,42g
M(Cr2O3) = 151,99 g/ mol
M(S) = 32,06 g/ mol
m(S) = ?
K2Cr2O7 + S ?› Cr2O3 + K2SO4
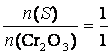
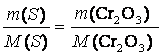
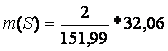
m(S) = 0,42g


