Příprava oxidu manganičitého (burelu)
MnO2 : černý prášek (tetragonální mřížka, též rombická modifikace), nerozpustný ve vodě, při teplotě 535°C se rozkládá na Mn2O3, nepatří tedy k nejstálejším oxidům manganu. Oxid manganičitý se vyskytuje i v hydratované formě, často je nestechiometrický. Jedinou stechiometrickou formou je tzv. ? – MnO2, který má rutilovou strukturu. Přestože je stechiometrický, může jeho složení kolísat mezi MnO1,93 až MnO2,0. Připravuje se mírným zahříváním dusičnanu manganatého, zatímco srážením z vodného roztoku, k němuž dochází např. při redukci manganistanu v slabě zásaditém prostředí, vzniká hnědočerný hydrát oxidu manganičitého MnO2 • nH2O. Na bezvodý oxid se nedá převést zahříváním – dochází k částečnému odštěpování kyslíku (viz. rozklad při teplotě nad 535°C).
Redukce manganistanu draselného siřičitanem sodným v neutrálním prostředí.
2 KMnO4 + 3 Na2SO3 • 7 H2O + H2O ?› 2 MnO2 + 3 Na2SO4 + 2 KOH + 7 H2O
2 KMnO4 + 3 Na2SO3 • 7 H2O + H2O ?› 2 MnO2 + 3 Na2SO4 + 2 KOH + 7 H2O
Chemikálie a pomůcky:
Manganistan draselný /O, Xn/ , heptahydrát siřičitanu sodného.
Postup práce: * Odvažte 1,82g KMnO4 a rozpusťte v 30 cm3 destilované vody.
* Odvažte 4,35g Na2SO3. 7 H2O a rozpusťte v 6 cm3 destilované vody.
* K roztoku manganistanu draselného přidejte roztok siřičitanu sodného.
* Ověřte, zda byl při reakci zredukován veškerý manganistan: Kapka reakční směsi nesmí na filtračním papíru zanechat skvrnu s fialovým okrajem.
* Není-li reakce skončena, přidejte ještě siřičitan. Pozor ! Siřičitan v zásobní lahvi časem podléhá oxidaci a mění se na síran.
* Vyloučenou sraženinu oxidu manganičitého odsajte a promyjte vodou.
* Výsledný produkt je klasifikován jako zdraví škodlivá látka /Xn/.
* Odvažte 4,35g Na2SO3. 7 H2O a rozpusťte v 6 cm3 destilované vody.
* K roztoku manganistanu draselného přidejte roztok siřičitanu sodného.
* Ověřte, zda byl při reakci zredukován veškerý manganistan: Kapka reakční směsi nesmí na filtračním papíru zanechat skvrnu s fialovým okrajem.
* Není-li reakce skončena, přidejte ještě siřičitan. Pozor ! Siřičitan v zásobní lahvi časem podléhá oxidaci a mění se na síran.
* Vyloučenou sraženinu oxidu manganičitého odsajte a promyjte vodou.
* Výsledný produkt je klasifikován jako zdraví škodlivá látka /Xn/.
m(MnO2) = 1 g
M(MnO2) = 86,93 g/mol
M(KMnO4) = 158,03 g/mol
m(KMnO4) = ?
2 KMnO4 + 3 Na2SO3• 7 H2O + H2O ?› 2 MnO2 + 3 Na2SO4 + 2 KOH + 7 H2O
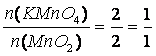
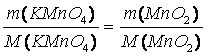
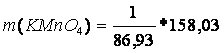
m (KMnO4) = 1,82 g
M(MnO2) = 86,93 g/mol
M(KMnO4) = 158,03 g/mol
m(KMnO4) = ?
2 KMnO4 + 3 Na2SO3• 7 H2O + H2O ?› 2 MnO2 + 3 Na2SO4 + 2 KOH + 7 H2O
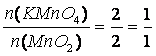
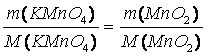
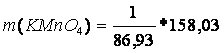
m (KMnO4) = 1,82 g


